|
천연물신약: 뭔 약인가?

장일무, 경희대학교 한의과대학 석좌교수
1. 천연물신약 탄생 배경
1) “신동의약 개발사업” G7 과제로 선정되다
서울대학교 천연물과학연구소는 1992년부터 당시 과학기술처에서 시행한 국책연구사업인 G7 프로젝트(Han Project) 중 하나의 과제로 “신동의약 개발사업” 주관 연구기관으로 선정 되었다. 이 과제가 여러 G7 프로젝트가 선정이 거의 끝날 무렵 뒤 늦게 선정이 된 이유는 당시 과기처 김진현 장관이 한·중 과학기술 협력 구축을 위한 중국 방문 시에 여러 도시를 방문하면서 느낀 바가 여러 과학기술 부문 중에서도 동아시아 전통의약인 한약 분야에서는 한국이 중국보다 앞서 나가야겠다는 뜻을 가지고 귀국한 즉시 한약 분야를 G7 프로젝트에 포함 시키라는 지시를 했다는 애기를 과기처 관계관에게 들은 바 있다.
약 20년 전 당시에는 미국을 비롯한 선진국에서는 한약의 가치를 모를 때이고 중국도 아직 신약개발 기술이 초보인 단계이기에 한국의 관련 과학기술자들이 선도적으로 한약을 소재로 신약 개발을 추진하면 승산이 있고 한국 나름대로 특성을 갖는 신약 개발 능력을 제고할 수 있다는 정책적 initiative를 확보한다는 의도로 판단된다.
천연물과학 분야에서 처음으로 대형 국책과제를 수행하는 내용에는 기반기술, 천연물성분화학, 효능 검색 및 어느 정도 연구가 추진된 과제를 제약기업과 협력하여 추진하는 산학 과제 등이 망라되어 있었다.
참여하는 인원은 천연물과학의 특성을 갖으면서 신약개발에 필수적으로 참여할 약학, 의학, IT 분야 및 제약기업의 연구자 등이 광범위하게 참여하여 1997년까지 5년간 약 70 억 정도의 연구비 지원을 받았다. 기반기술연구로는 각종 한의약 고전의약서의 효능 부분 및 약재, 성분화학 등이 망라된 데이터베이스 구축이 이루어졌는데 그 창출품이 현재에도 전 세계에서 가장 많이 사용하는 TradiMed Database(www.tradimed.com)이며 국문, 영문, 일문으로 서비스를 하고 있다. 이 데이터베이스 정보 활용 정보로 창출된 것이 국내 천연물신약의 하나인 “조인스”라고 해당 기업의 연구자로부터 들은바 있음은 “신동의약 개발사업”의 하나의 성공 사례라고 할 수 있다.
“신동의약 개발사업”은 원래 5년 과제였기에 1997년에 종료가 되었다. 과제 수행을 통하여 각 참여자와 참여 기업들은 한약의 효능 정보를 현대적으로 실증하여 신약을 개발할 수 있다는 가능성을 확신하게 되었으며 과제 수행의 주관기관인 천연물과학연구소는 나름대로 여러 기반기술과 경험 및 노하우를 축적하는 계기가 되었다.
이는 동북아시아 지역에서 오랜 동안 사용해온 전통동양약물이 갖는 약효를 현대적으로 해석하여 실증함으로써 신약개발을 창출할 수 있으며 시간적, 경제적으로도 유리할뿐더러 부수적으로 한약의 과학화를 구현할 수 있을뿐더러 한자 문화권 국가에서 선도적으로 경쟁력을 확보할 수 있다는 장점이 있다.
실제로 천연물과학연구소에 설치한 한·중 전통약물협력센터의 인력 교류 프로그램으로 중국의 수많은 과학자와 관료들이 연구소를 방문하여 신약 개발의 현장을 견학하는 일이 빈번하였다. 한편 우리의 “신동의약 개발사업”을 벤치마킹한 중국 정부 측에서 유사한 프로젝트(봉화 프로젝트) 등을 만들어 연구 사업을 추진하기도 하였다.
1992년에 시작한 “신동의약 개발사업”이 1997년 말에 G7 프로젝트 분야에서 종료되었으나 과거 5년간의 경험에 비추어 한약을 소재로 한 신약개발이 한국 제약계의 신약개발 목표를 성취하는데 중요한 장점 분야임을 확인하게 되었으며 이러한 연구개발이 최소한 10년 동안은 중단 없이 추진되어야 신약 창출의 과실을 기대할 수 있기 때문에 연구소 교수들을 중심으로 정부 지원을 법제화하려는 시도가 태동되었다.
2) 천연물신약 연구개발촉진법 및 시행령 법제화
우리의 전통약물인 한약은 단미(single herb) 또는 복미(muti-herbs)로 구성된 처방(formulae)이며 문헌상으로는 대략 10 만종의 처방이 기록되어있다. 처방을 구성하는 소재 자체는 대부분 식물인 약초(약간의 동물성, 광물성 약재도 있음)이고 이들 약초의 약효 성분은 거의 식물의 2차 대사물(secondary metabolites)이며 이를 천연물(natural products/natural substances/natural constituents) 또는 천연물 성분이라고 부른다.
약 2 천년 넘게 사용하여온 약초요법에서 특정 효능이 확인된 처방이 주로 문헌에 기록으로 남게 되었고 효능이 없다거나 독성이 심한 것은 폐기 되었다고 인정한다면 한약 처방은 매우 풍부한 전통약물 지식의 보고라고 할 수 있다. 다만 대부분이 한자로 기술되어있기 때문에 한자를 모르는 서양인은 정보 접근이 어려운 실정이나 오히려 이 점이 우리에게는 신약개발에 매우 유리한 장점으로 작용하는 면이 있다.
한약의 소재인 약초는 우리나라나 중국에만 있는 것을 사용하는 게 아니고 중동 지방, 동남아 지역 등의 약초도 사용함으로 신약개발 소재를“신동의약” 즉 한약만을 표방하는 것보다는 외국의 약초도 연구개발 대상이 될 것임으로 천연물로 표기하는 것이 미래 지향적이라는 점과 천연물과학연구소의 명칭이 종래에는 생약연구소이었으나 1992년에 천연물과학(Natural Products Sciences)라는 명칭을 사용하여 천연물과학연구소라고 개칭한 점을 감안하게 된다.
특히 천연물과학이라는 명칭이 갖는 의미는 천연물 특히 한약을 다루려면 최소한 4 가지 분야의 지식과 기술 즉 약초의 자원 및 식물학적 분류기술, 천연물의 성분화학적 지식과 기술, 천연물의 약효를 해석하고 실증하는 지식과 기술, 전통의약서에 기술된 처방 및 약재 등의 방대한 각종 전통지식정보와 데이터베이스 구축기술 등을 이해하고 고루 갖추어야만 천연물을 소재로 신약 및 기타 고부가가치 유용 천연물 제품을 창출할 수 있다는 의미가 내포된 명칭이다.
“신동의약 개발사업”을 수행하면서 느낀 애로 사항은 천연물을 다룰 줄 아는 고급인력 즉 천연물과학자가 매우 부족하다는 점이었다. 물론 생약학, 한의약 분야의 인력은 배출이 되고 있지만 위에서 언급한대로 종합적이고 다양한 천연물 지식을 갖춘 인력이 특히 제약업계에 적기 때문에 우리나라의 제약업계가 천연물/한약을 활용한 신약개발의 중요성을 인식하고도 실제로 이를 추진할 인력이 부족하기 때문에 활성화 시키는 데에는 한계가 있다는 점이 문제였다.
그래서 천연물과학연구소에 서울대학교 개교 이래 처음으로 1998년에 연구소에 천연물과학 협동과정이 설치되어 석사 및 박사 과정 고급인력 배출이 시작되었다. 석사과정에서는 전반전으로 4가지 분야의 천연물과학 지식을 교육 및 실습하고 박사 과정에서는 4가지 분야 중 하나를 택하여 전문성을 심화시키는 교육 과정이었다. 즉 학부에서 다양한 전공, 예컨대, 약학, 생물, 의학, 한의학, 화학, 식품영양학, 정보학 등을 이수한 학생이 학부 전공과정에 더하기 천연물과학의 제반 지식을 습득시켜서 천연물과학자를 배출하는 교육 모델이라고 생각하면 이해가 쉬울 것이다.
이러한 새로운 전문적 응용학문 분야를 만들 경우에는 매우 위험성이 있기도 하다. 만약 실패를 한다면 배출한 고급인력이 졸업 후 갈 곳이 없게 되고 결국은 과정 자체가 소멸되기 때문이다. 그러나 이러한 우리 연구소의 연구와 교육을 병행하는 전략이 성공적이었다는 점은 미국도 우리 연구소를 벤치마킹한 후에 연방정부 지원의 국립천연물연구센터(National Center for Natural Products Research)를 미시시피대학교 구내에 설립한 점이다(그림 1).
이 국립천연물연구센터가 미시시피대학교 구내에 설립된 이유는 미국 내 약초 연구를 위한 정부 지원의 약초시범재배포가 미시시피대학교에 있으며 약학대학과 협력하여 교육과 연구를 병행할 수 있는 여러 장점이 있기 때문이다. 국립천연물연구센터가 설립된 후에 미시시피 대학교 교수와 센터 연구진이 실제로 우리 연구소를 방문하여 전한 말이 “한국 같은 작은 나라에서도 천연물과학연구와 교육을 잘하는 연구소가 있는데 미국도 늦게나마 시작하여야 한다고 주 상원의원을 통하여 강력히 연방정부를 설득시킨 결과”라는 좀 씁쓸한 말을 듣게 되었다.
우리 연구소 교수들이 천연물 연구개발을 위한 정부의 지원책을 강구하기 위하여 법제화를 서두르는 시기는 마침 한국이 IMF 라는 재정적 위기를 맞고 있던 1998~2000년 기간이었다. 그럼에도 불구하고 국회에서 “천연물신약 연구개발 촉진법”이 의원 발의로 통과되었는데 연구소 교수들의 열성적 노력과 아울러 이상희 의원(전 과기처 장관/국회의원 역임; 현 서울과천과학관장)의 이해와 적극적 지원에 힘입은바 크다.
2. 천연물신약 연구개발촉진법 및 시행령의 주요 내용
1) 법령의 목표 지향점은 무엇인가?
모든 법령은 추구하는 목표가 있으며 지향점이 명확하여야 한다. 천연물신약 연구개발촉진법(이하 “촉진법”)과 동 시행령(이하 “시행령) 역시 추구하는 목표가 명확하며 크게 두 가지 지향점을 갖고 있다.
“촉진법”은 2000년에 제정 및 발효되었는데 총 14 조 및 부칙이 있으며 주무 부처는 보건복지부(이하 “복지부”)이다. 제 1 조를 살펴보면 목표 지향점이 분명하다. “이 법은 천연물과학의 육성 등 천연물신약연구개발의 기반을 조성하고 천연물을 이용한 신약연구개발과 그 개발기술의 산업화를 촉진하여” 라고 기술되어있다. 이는 천연물 소재를 활용하여 신약 개발을 촉진하며 이에 필요한 기술 분야로 천연물과학을 육성하여 신약 개발에 참여할 과학자를 양성하여야 한다는 두 가지 목표 지향점을 분명히 하고 있다.
이러한 목표를 원활히 달성하기 위하여 “복지부” 장관을 위원장으로 하는 천연물신약연구개발정책심의회(이하 “심의회”)를 구성하게 되어있다. “심의회” 구성 및 역할에 관한 부분은 “시행령”에 반영되어있으며 구성인원은 관계 정부 부처인 기획재정부차관, 교육과학기술부차관, 농림수산식품부차관, 지식경제부차관, 보건복지부차관, 식품의약품안전청장을 비롯하여 관련 분야 학계 인사 및 시민단체 인사를 포함하여 20 인 이내로 구성된다.
“심의회”의 주요 업무는 모법인 “촉진법” 이 추구하는 목표 달성을 위한 정책 개발 및 지원책을 마련하는 역할을 수행한다. “심의회”는 “복지부” 관련 부서에서 간사 1 명을 지명하여 업무를 수행하도록 하고 있다. 그리고 매년 1 회 개최하여야하며 필요시에는 임시 회의를 개최할 수 있다.
이와 같이 중요한 역할을 하는 “심의회”가 법 제정 이후 10년이 지난 시점에서 볼 때 최소한 10 회는 개최되었어야 하고 “촉진법”이 추구하는 목표 지향점을 어느 정도 달성하고 있는지에 대해 자체 평가가 이루어졌어야 마땅한데 과문한 탓인지 그 내용을 확인할 수가 없다.
다만 대략 5년 주기로 “복지부”가 “촉진법” 관련 사업계획을 설명하고 관계자들로부터 듣는 공청회 비슷한 모임이 있기는 하다. 그러나 “촉진법”이 2000년에 발효된 이후 국내에서 현재까지 과연 천연물을 활용한 신약 개발 분야가 정부 지원책에 힘입어 획기적인 발전을 하고 있다고는 볼 수 없는 것이 현실이다. 즉 법은 있되 지원책은 크지 않았기 때문에 그 성과도 국내외적으로 미미하다고 할 수 있다.
“촉진법”에 의한 지원책에 관한 부분으로 “촉진법” 제 8 조에는 (공동ㆍ협동연구개발의 촉진) 보건복지부장관은 천연물신약연구개발을 효율적으로 추진하기 위하여 산업계ㆍ학계 및 연구기관간의 공동ㆍ협동연구개발을 촉진하여야 한다. 그리고 “시행령”12 조에는 이에 관한 구체적 집행 사항으로 (관련 전문기관ㆍ단체의 지정활용 등) ①보건복지부장관은 법 제12조의규정에 의하여 다음 각호의 전문기관ㆍ단체를 법 제8조의 규정에 의한 공동ㆍ협동연구개발 등을 할 수 있는 관련 전문기관ㆍ단체로 지정하거나 활용할 수있다. 이 경우 보건복지부장관은 관련 전문기관ㆍ단체와 미리 협의하여야 한다.
그 전문기관으로 선정할 수 있는 기관은 1)고등교육법 제2조의 규정에 의한 학교중 천연물신약 연구개발을 전문적으로수행하는 학교 2)민법 또는 다른 법령에 의하여 연구업무를 주된 목적사업으로 하여 설립된 법인인연구기관으로서 천연물신약연구개발을 수행하는 기관 3)기타 보건복지부장관이 천연물신약 연구개발에 적합하다고 인정한 기관 또는 단체이며 각 전문기관의 구체적 역할도 7 가지로 명시 되어있다. 이러한 “시행령”에 의거 초창기에는 천연물과학연구소가 지정된 바 있었고, 그 이후에 한국보건산업진흥원이 일정액의 연구비를 천연물신약 부분에 투입한 적은 있다. 그러나 지속적인 지원과 지정기관의 확대 등은 아주 미흡한 실정이었다.
최근에 지식경제부가 천연물신약개발에 관한 지원에 착수한 것이 아마도 “촉진법” 발효 이후에 획기적 지원에 불과하지 않나 생각이며 다행한 일이기도 하다. 이는 지난 10년 동안 “심의회”참석 관계 부처인 기획재정부, 교과부, 농림부, 식약청 등이 소극적이었는지 아니면 주무 부서인 “복지부”가 소극적이었는지는 알 수가 없으나 결과적으로 10년 세월을 보내면서 천연물로부터 신약개발을 하자는 촉진 정책은 그리 빛나는 게 못 된다는 뜻이기도 하다.
그러면 왜 이런 일이 벌어졌는가? 그 이유가 단지 정책 집행 부서인“복지부”만의 탓인가? 아니면 제약기업을 비롯한 학연 기관의 문제인가? 등을 살펴보는 것도 “촉진법”이 추구하는 신약 개발의 활성화를 위하여도 좋을 것이다.
2)목표는 명확한데 통합적 추진 정책이 이 미흡하다
우선 “촉진법”의 용어부터 점검해 보자. 제 2 조에는 “천연물”, “천연물 성분”, 천연물신약” 및 “천연물과학”이라는 용어의 정의가 있다. 여기서 천연물은 육상, 해상의 생물체를 활용하여 유용한 산물을 얻는 것을 의미하며, 천연물 성분은 그 유용성을 갖는 천연물 중의 특정 성분을 뜻한다.
즉 여러 효능을 발현하는 원인 물질을 의미한다. 그리고 이러한 효능 물질 중에서 약효를 발현하는 작용을 밝혀서 신약화하는 것이 천연물신약이 될 것이다. 여기서 주목할 부분은 “천연물신약”이라는 것은 “천연물”이라는 소재를 이용하여 그 약효 즉 효능을 명백히 과학적으로 실증하는 것이 요구되며(evidence-based), 그 신약의 조성이 최초로 규명된 것이나 그 효능이 최초로 규명된 것이 “천연물신약”이라는 것이다. 이렇게 천연물신약을 창출하는 기술이 “천연물과학”이라는 학문/기술 분야라는 것을 정의하고 있다.
여기서 “천연물신약”이라는 용어를 좀 더 세밀히 살펴볼 필요가 있다. 즉 천연물 성분을 이용하여 연구 개발한 의약품으로서 조성성분, 효능이 새로운 의약품이다. 여기서 주목할 점은 천연물 성분만을 활용한다는 뜻 즉 페니실린이나 몰핀 같은 양약적 약물과 그러한 성분이 포함된 천연물 즉 추출물 형태의 약물인 생약제제나 한약제제 형태의 약물을 포함한다는 뜻으로도 해석할 수 있다. 즉 양약이나 생약/한약이라는 두 가지 약물을 포괄적으로 포함한다는 뜻이 된다.
여기서 약물의 허가 규제기관인 식품약품안전청(이하 “식약청”)의 허가 요건에 혼란을 초래할 수 있었다. 현재까지는 식약청 당국에서 성분만 단리한 조성 및 효능이 새로운 천연물 성분은 천연물신약의 범주로 허가 신청을 받지는 않고 있는 것으로 알려져 있다. 다만 총 추출물(total extract)을 어느 정도 분획 (fractionation)한 것은 허가 요건에 해당 된다는 잠정적 운용을 하고 있다. 이와 관련하여 실례를 들어 보자. 아래 표는 “촉진법”이 제정 및 발효된 후 얼마 지나지 않아 식약청이 발표한 안전성 유효성 관련 허가 요구 사항을 도식화한 것이다 (표 1).
여기서 살펴보면 생약제제로써 신약(1 & 2)(단일 및 복합제)의 허가 요구사항 부분과 천연물신약의 허가 요구사항이 일치함을 볼 수 있다. 즉 신 생약제제나 천연물신약이나 별 차이가 없다는 뜻도 된다. 그리고 최근에 식약청에서 공표한 자료 두 가지 인데 허가 절차를 나타내는 도식 부분에서 즉 생약 또는 한약제제의 허가를 받는 절차를 볼 수 있고 새로운 신약의 생약제제는 신약(1 & 2)의 규정에 따른 허가 요구 사항을 필요로 한다. 이는 종전과 같다.
다만 둘째 표에 적시되어있듯이 여기에는 ‘(천연물신약 포함)’이라고 표시되어 있다. 이러한 허가 요구 사항을 적용한다면 결국 신 생약제제와 천연물신약을 어떻게 구별이 가능한가 하는 문제이다. 특히 제약기업에서 개발한 제품을 허가 받고자 할 경우 신 생약제제로 할 것인지 아니면 천연물신약으로 할 것인지 혼란스럽게 될 것으로 생각한다.
더욱이 천연물신약 연구개발을 촉진한다는 정부 정책의 방향성 정립과 목표 지향점에 혼란을 야기할 수 있다는 점이다. 식약청 당국은 과거에는 생약제제 및 한약제제 두 가지 약물에 대한 허가 요건만 존재했었는데 천연물신약이라는 새로운 약물이 나타남으로써 별도의 약물로 인식하였다는 점이 혼란을 야기할 수 밖에 없었다고 본다. 특히 약사법에도 없는 약물의 명칭이기에 여기서 천연물신약의 용어 개념 즉 천연물 성분과 또는 천연물 추출물이라는 양면성을 갖는 부분을 기존의 생약제제와 전통약물인 한약제제와의 연계한 통합 과정이 필요하다고 여겨진다.
이는 현재 미국 FDA와 유럽연합의 EMEA가 운용하는 Guidance for Industry: Botanical Drug Products 및 Herbal Medicine 규정이 글로벌 표준으로 된바 우리의 생약, 한약, 천연물신약의 특성을 살려 이들 미국 및 유럽의 규정과 조화를 이루는 것이 제약기업인 산업체와 천연물과학을 연구 및 교육하는 학연 기관에게도 필요한 사항이기 때문이다.
예컨대, 스티렌 및 조인스가 천연물신약의 대표적 성공사례라고 거론 되지만 이들이 미국이나 유럽 시장에 진출하려면 위에 언급한 미국과 유럽의 제반 법규에 따라 또 다시 여러 시험을 한다면 시간적, 경제적 손실이 크기 때문이다. 이제는 우리의 규정도 가능한 글로벌 표준을 따라 새로이 손질할 필요가 있다고 본다. 그리고 천연물신약이라는 용어 즉 명칭도 신약의 소재가 천연물이라는 것이지 결국은 신 천연약물에 해당이 된다.
미국 FDA가 Botanical Drug Products라고 명명한 이유도 여러 천연약물 즉 생약, 전통약물을 포괄하는 개념을 나타내기 위한 명칭이기에 천연약물이 오히려 부르기 편리하다. 식약청에서도 천연물의약품 (Phytomedicines)이라는 용어를 최근에는 사용하고 있지만 우리말로 부르기에는 좀 기다란 명칭임으로 오히려 포괄적 개념으로 천연약물 (natural drugs 또는 natural drug products)로 표기함이 타당하지 않나 생각도 해 본다. 해당 용어와 명칭이 내포하는 의미가 불확실하다면 결국 목표 지향점이 혼란스러운 것은 당연한 일이 아닌가 한다.
특히 기존의 생약제제로서 신약의 허가 조건과 천연물신약의 허가 조건이 유사하다면 “촉진법”이 지향하는 천연물신약의 활성화 내지 국제경쟁력 확보에 별 도움이 되지 않음으로 식약청도 좀 더 허가 조건을 보수적으로만 운용하지 말고 좀 더 시간적, 경제적으로 제약계에 도움을 줄 수 있는 규정 마련에 노력할 부분이라고 생각한다.
3) US FDA의 Botanical Drug Products (BDP) 규정
이 규정은 우연인지 필연인지 알 수 없지만 2000년에 우리의 “촉진법”이 제정 공포된 해와 같은 해에 일단 초안이 만들어졌고 이를 약 3년간 시행하면서 부족한 부분을 보완하여 2004년에 확정 공포한 일종의 고시이다. 현재 세계 각국에서 약 340 건이 Investigational New Drugs (IND) 신청을 하고 있으며 녹차를 이용한 외용제 1 건이 이미 BDP로 허가 된 바 있다.
미국 식약청이 BDP 규정을 제정한데에는 다목적 포석을 한 것으로 보여진다. “90 년대 초와 중반에 미국-유럽 제약계 연합 (특히 대중약 업계)가 연합하여 미국 식약청에 제출한 건의문 (European-American Phytomedicines Coalition petitions to FDA:EAPC)에는 약초 (herbs) 중에서 많은 임상시험 결과를 거쳐서 확실한 효능이 밝혀진 것들, 예를 들면, 생강(ginger)의 구토진정작용 또는 쥐오줌풀 (valerian)의 진정 및 수면 촉진 작용은 임상시험 및 후속 안전성 모니터링에서 안전하다는 결과가 잘 알려져 있고 이들은 유럽에서 대중약 (Over-The-Counter:OTC)으로 제조 및 판매가 가능한데 미국에서는 대중약으로 허가가 안되는 점을 개선하여야 한다는 건의문에 대하여 미국 식약청은 아예 대응조차 하지 않는 보수적 행태를 보여왔다.
그러나 `1994년에 미국 의회에서 보조식품법 (Dietary Supplements Health Education Act: DSHEA 또는 Hatch-Harkin 의원 제안 법안)이 법안으로 제정이 되었으며 여기에는 비타민, 향신료 및 미네랄, 사하작용 등 보조식품이 포함되어 있고 이들 제품의 원료 중에는 약초/생약 (herbal materials) 소재를 활용한 제품이 대부분이고 과거 OTC 약물에 해당 될 수 있는 것들이 많았다. 특히 이들 보조식품의 효능 표기가 약물의 적응증에 가까운 표기 (예를 들면 콜레스테롤 수치를 낮춘다)에 미국 식약청이 제재를 가하였으나 대법원에서 미국 식약청 제재가 잘못되었다는 판결이 나온 이후에는 미국 식약청의 입장이 매우 난처하게 되었다.
이러한 규정상 모순 내지 갈등을 해결하는 하나의 방편이 BDP 제정의 배경 중의 하나일 것으로 추축이 된다. 또 하나의 목적은 미국이 국립보건원 (NIH)에 대체보완의약분야 (NCCAM)부서를 설치 (1992년에 설치 이후 센터로 1998년에 확대)한 후 여러 한약 (Traditional Chinese Medicines) 연구가 확대되면서 이들에 대한 임상연구 결과가 효능 면에서 인정할 만한 것이 많이 발견됨으로써 향후 한약을 신약의 소재로 활용하면 미국의 제약업계가 새로운 영역의 신약 분야에서 이니시아티브를 장악할 수 있겠다는 장기적 포석으로 BDP 규정을 제정한 측면도 보인다.
이러한 신 규정 때문에 전통약물의 강국인 중국, 인도 등이 매우 예민하게 반응하고 전통약물의 지적재산권 (intellectual property) 부여 요구가 제기되어 세계무역기구 (WTO) 산하의 세계지적재산권기구(WIPO)에서 이를 인정하게 되는 국제적 움직임도 일어났으나 이 부분에 대한 해설은 여기서는 생략하기로 한다.
BDP의 주요한 내용과 그 운용을 요약하면 아래와 같다 (그림 2). BDP 는 식품 (보조식품 포함), 약품, 화장품의 소재로 활용되며 약품의 경우 대중약 (비처방 OTC)과 전문약 (prescription drugs: ethicals 라고도 한국, 일본에서는 부름)으로 구별되어 허가 되는데 OTC 의 경우 일반 식품 및 보조식품으로 사용하던 제품에서 어떤 효능을 발견하면 약품으로도 전환이 된다.
이 경우 material time 및 extent는 5 년이상 판매된 실적 및 1,000 만 dose의 사용 실적을 요구하는게 보통이며 적응증에 합당한 효능의 증거가 있으면 OTC로 전환 신청을 하게 되며 규정집 (OTC monograph)에 수재된다. 만약 이러한 대중약이 독점판매권을 요구하려면 임상시험을 거쳐야 하고 임상시험에서 효능과 안전성이 인정될 경우 사례에 따라 3-5 년 독점판매권(market exclusive)를 부여한다. 이 정도 기간이면은 신약 개발 투자비를 회수하는데 큰 어려움이 없다.
특히 BDP 신약의 경우에는 양약의 경우 보통 15 년 시험기간에 5억불 정도가 소요된다는 엄청난 비용을 부담하지 않고 빠르게 신약허가를 받을 수 있는 장점이 있다. 우리나라도 독점판매권이 있다고는 한다. 미국 BDP 허가 규정의 특징은 과거 충분한 사용 예 (전통약물의 경우로 많이 사용한 처방 등)와 특히 건강보조식품으로 충분한 사용 기간과 안전성이 확보된 경우 임상 1 상이 면제되며 비임상시험에서도 면제 부분을 준다. 이 점은 우리의 천연물신약 허가 조건에서도 반영할 부분이라고 여겨진다 (그림 3).
BDP 약물의 경우에는 허가 규정에서 몇가지 유의할 부분으로 제조과정에서 합성 제조공정이 포함되거나 발효 공정이 포함되는 제품은 해당이 아니 된다. 그리고 제품 중에서 일정 부분이 추출물이고 나머지 부분이 순수 분리된 천연성분이 함유된 것도 BDp 허가 규정에 벗어난다.
소재로는 식물 (약초) 및 동물성 생약재 및 광물성 약재를 모두 포함하며 이들이 혼합된 추출물도 해당이 된다 (표 2). 이는 결국 한약이라는 표현만 아니 했지 결국은 한약과 동일하다. 다만 제조 공정에서 CMC (Chemistry, Manufacturing, Control) 즉 기준 및 확인 시험과 cGMP 시설에서 제조한다는 것 등은 모두 ICH 가이드라인의 적용을 받는다. 확인시험에서 약효성분이 확인되지 않는 경우 및 지표 물질도 확인이 어려운 경우에는 Finger print (pattern분석 또는 profile) 등으로 확인 결과를 제출할 수 있다.
그리고 제품의 원 식물 표본도 함께 제출하는 것을 요구하고 있다. 그러나 식물 소재가 GAP에 의한 것을 반드시 사용하라는 의무 조항은 없다. 이는 미국 자체가 약초 재배에 대한 GAP 규정을 적용하는 가이드라인이 없기 때문이기도 하다.
임상시험 역시 GCP 규정을 따르면 되나 유의할 부분은 임상에 사용하는 시험용 약물을 충분히 준비하는 게 필요하다. 즉 임상 완료 시까지 소요되는 양이 마련되어야지 임상시험 중에 약물이 모자라서 다시 만들어 제공하는 것은 사실 상 임상 시험 자체를 원점으로 돌리는 것과 같다. 이 점에서 우리 기업들이 시행착오를 겪지 않아야 한다.
유럽의 경우 EMEA의 Herbal Medicine Directives 규정이 미국의 BDP 규정과 유사하다. 그리고 임상시험이나 비임상시험 방법 등이 모두 ICH의 회원국 (미, 유럽, 일본) 임으로 방법 자체는 동일한 가이드라인을 사용한다. 다만 전통약물이라는 개념 자체에서 얼마나 오래 사용한 약물을 전통약물로 할 것인지가 다를 수 있다.
대략 한 지역에서 30 년 이상 사용한 생약이라면 전통약물의 범주에 넣을 수 있다는 해석을 하지만 실제로는 EU 회원국 중에서 해당국의 허가조건을 따르는 이중적 허가 과정을 거치는 것임으로 진출하려는 해당국의 규정을 먼저 살피는게 중요하다. 일본의 경우는 한방약 (Kampo)을 전문약과 대중약으로 나누어 허가 하기 때문에 한방약 중심의 제약산업이 한국에 비하여 매우 활성화 되어있다.
왜냐하면 240 종이 넘는 한방약이 의료보험에서 비용을 지불하는게 큰 원인이다. 이 점은 우리나라의 단미 엑스를 조제하여 한방약 처방을 인정하는 의료보험 제도가 한약 산업의 발전을 저해하는 큰 요소가 된다는 점을 지적 아니할 수 없다. 이러한 제도 때문에 한방 제약기업이 쇠퇴하였고 결과적으로 신 생약 약품이건 천연물신약이건 모두 개발의지를 약화시키고 있다. 이러한 여건 개선이 바로 천연물신약 활성화의 첫걸음이 됨으로 관련 규정의 통합적 개선이 촉구된다.
이와 더불어 “촉진법”에서 분명히 적시한 부분이 “천연물과학”에 대한 학문적, 기술적 향상을 추구하라는 점에서는 천연물과학자 양성에 투자를 해야만 전문적 고급인력이 산학연에 고루 확산이 된다. 이 부분에서는 보건복지부와 지원 부처인 교육과학기술부가 협력하여 획기적 발전 방안을 만들어야 만 “촉진법”의 의의를 살리는 길이라고 생각된다.
3. 결론
“촉진법”이 제정된지 10 년 세월이 지났지만 짧지 않은 이 기간 동안에 주무 부처인 보건복지부가 실질적으로 천연물과학 육성과 천연물신약 개발에 얼마나 관심을 가지고 정책 개발 및 지원을 하였는지 의문이다. 그저 신약개발의 필요성이 산학연에서 제기하였을 때 일과성 대책으로 지나지 않았나 생각된다.
더불어 식약청에서도 허가 조건을 좀 더 개선하여 생약, 한약 및 천연물신약을 포괄하면서 시간적, 경제적으로 이익을 줄 수 있는 허가 조건을 개발하는 노력을 하였는지도 의문 스럽다. 천연물신약이라는 명칭이 어떤 제품의 판매 효과만 높일 수 있는 명칭으로 남겨서는 한국적 장점과 국제 경쟁력 확보가 가능하다는 천연물신약의 연구개발이 활성화 될 리가 없다.
이러한 허가 제도에서 지경부가 처음으로 지원을 하는 프로젝트가 근래에 발표되었지만 그 결과물이 과연 국제 시장에서 경쟁력을 확보할 수 있는 제품이거나 미국, 유럽 시장에 진출할 수 있는 제품이기를 바라지만 그저 국내용일 가능성이 높지 않나 생각된다.
이제는 일과성이 아니고 액수는 적더라도 지속적인 지원과 정책 개발만이 한국도 신약 창출 국가로 진출하리라 생각한다.

그림 1. 미국 연방 정부 천연물연구센터 (미시시피대학 구내)
표 1. 생약 및 천연물신약 안전성 유효성 제출 자료 일부
|
구분
자료번호 |
Ⅰ. 신약 |
Ⅱ. 천연물신약 |
|
1. 본질조성 또는 기원이 전혀 새로운 생약을 주성분으로 하는 단일제 |
2. 위 1의 생약을 함유한 복합제 |
3. 대한약전 또는 식품의약품안전청장이 정한 공정서 및 의약품집, 한약서, 보건복지부장관 또는 식품의약품안전청장이 따로 기준 및 시험방법을 고시한 생약 또는 이들로 구성된 생약제제 중 처방근거가 없는 전문의약품에 해당되는 주사제, 패취제 |
1. 조성성분이 새로운 의약품 |
2. 효능이 새로운 의약품 |
|
1 |
|
○ |
○ |
○ |
○ |
○ |
|
2 |
|
○ |
○ |
○ |
○ |
○ |
|
3 |
가 |
○ |
○ |
○ |
○ |
○ |
|
나 |
△ |
△ |
△ |
△ |
△ |
|
4 |
가 |
○ |
○ |
○ |
○ |
△ |
|
나 |
○ |
○ |
○ |
○ |
△ |
|
다 |
○ |
○ |
○ |
○ |
△ |
|
라 |
△ |
△ |
△ |
△ |
△ |
|
마 |
△ |
△ |
△ |
△ |
△ |
|
바 |
△ |
△ |
△ |
△ |
△ |
|
사 |
△ |
△ |
△ |
△ |
△ |
|
아 |
△ |
△ |
△ |
△ |
△ |
|
5 |
가 |
○ |
○ |
○ |
○ |
○ |
|
나 |
○ |
○ |
○ |
○ |
○ |
|
다 |
X |
X |
X |
X |
X |
|
6 |
가 |
○ |
○ |
○ |
○ |
○ |
|
나 |
△ |
△ |
△ |
△ |
△ |
|
7 |
|
○ |
○ |
○ |
○ |
○ |
|
8 |
|
○ |
○ |
○ |
○ |
○ |
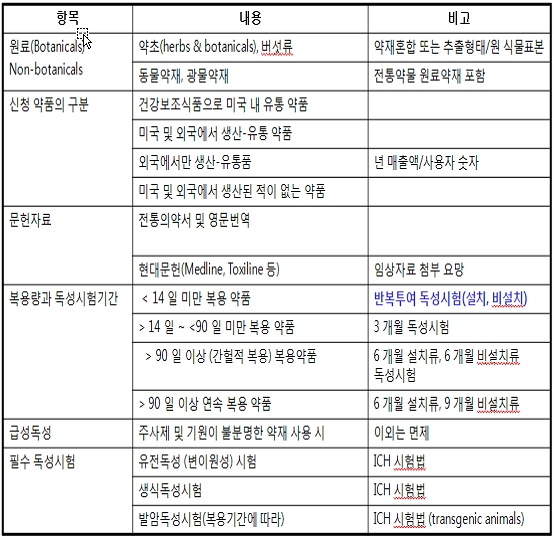
표 2. 미국 식약청 고시 Botanical Drugs 허가 조건 요약

그림 2. 미국 식약청 BDP 소재 제품의 상호 허가 요구 흐름도
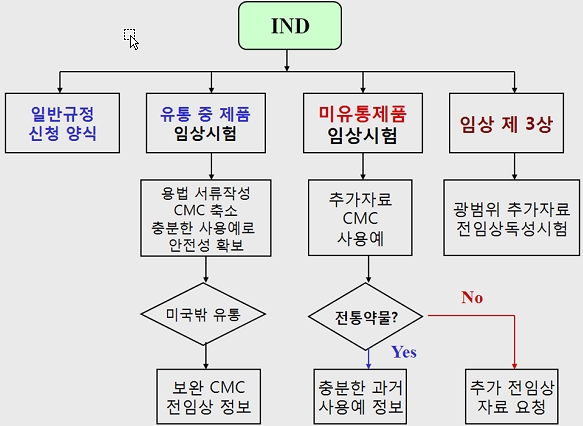
그림 3. BDP 시험용 신약 임상 시험 허가 조건 흐름도
| 
 장일무-천연물신약.pdf (719220) bytes
장일무-천연물신약.pdf (719220) bytes 















